Your new post is loading...

|
Scooped by
Life Sciences UPSaclay
October 10, 2019 5:36 AM
|
Elias Fattal a été élu Président de la section 2 de l'Académie Nationale de Pharmacie.
A partir de janvier 2020, le Professeur Elias Fattal, directeur de l'Institut Galien UMR-8612 de la Faculté de Pharmacie de l'Université Paris-Sud, succèdera à Christine Capdeville-Atkinson à la présidence de la section 2 de l'Académie Nationale de Pharmacie. Cette section intitulée Sciences pharmaceutiques appliquées au médicament et aux autres produits de santé, est dédiée à l'étude des sujets relatifs à la connaissance du médicament et des produits de santé. En particulier dans les domaines de la pharmacie galénique, la pharmacologie expérimentale et clinique, la toxicologie expérimentale, la clinique ainsi que la botanique, la pharmacognosie et la cosmétologie. Elias Fattal succèdera à Christine Capdeville-Atkinson et prendra ses nouvelles fonctions à partir de Janvier 2020.

|
Scooped by
Life Sciences UPSaclay
January 27, 2019 11:11 AM
|
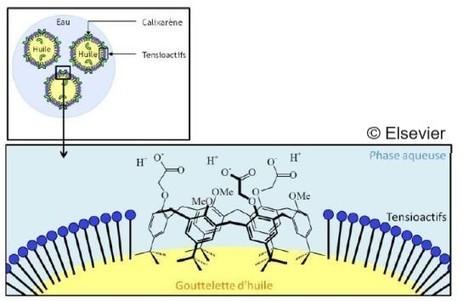
Lors d'une contamination cutanée par des radionucléides, dans un laboratoire ou une installation nucléaire, la priorité est d'empêcher ces éléments de franchir la barrière de la peau, afin d'éviter leur passage dans le sang et la contamination d'autres organes. Jusqu'à présent, le seul traitement d'urgence, peu efficace, consistait à rincer la zone contaminée à l'eau savonneuse. Une équipe de chercheurs de l'Institut de radioprotection et de sûreté nucléaire (IRSN) et de l'Institut Galien Paris-Sud (IGPS, membre du LabEx LERMIT) a mis au point une crème lavante qui, en piégeant les atomes d'uranium ou de plutonium, empêche leur diffusion à travers la peau. Ce travail a fait l’objet de deux thèses financées par la Direction générale de l'armement. Les chercheurs sont partis d'une famille de molécules, les calixarènes, qui peuvent piéger des atomes d'actinides (uranium, plutonium...) grâce à leurs propriétés chimiques et à leur géométrie. Les calixarènes étaient déjà connus mais n'étaient utilisés que pour extraire et analyser des actinides dans des milieux biologiques ou dans l'environnement. « Pour utiliser des calixarènes en décontamination cutanée, tout le problème était de trouver la formulation -la forme galénique- qui permettrait de l'appliquer efficacement sur la peau », indique Elias Fattal, directeur de l'Institut Galien Paris Sud. La forme retenue pour le traitement cutané est une nanoémulsion – des gouttelettes d'huile dans l'eau. En effet, les calixarènes sont des molécules solubles dans l'huile. En utilisant le calixarène carboxylique2, les chercheurs ont pu montrer que la molécule active se place à l'interface entre les gouttelettes d'huile et l'eau, avec les parties complexantes de la molécule dans la phase aqueuse. Les atomes d'uranium sont ainsi piégés à la surface des gouttelettes d'huile, trop volumineuses pour être absorbées par la peau. Deux thèses successives ont permis la mise au point du traitement. Elles ont démontré son efficacité : la diffusion de l'uranium dans la peau est réduite de 95% quand la nanoémulsion est appliquée immédiatement (et conserve une efficacité à 71% si l'application est retardée de 30 minutes). Les études ont aussi montré l'absence de toxicité ou d'effet inflammatoire de l'émulsion. Sous la forme d'une crème lavante, le nouveau traitement cutané (un dispositif médical de classe 1) a obtenu l'autorisation de mise sur le marché de l'ANSM et est commercialisé par le laboratoire pharmaceutique Cevidra. L'IGPS et l'IRSN devraient démarrer prochainement de nouveaux projets portant sur le traitement d'autres types d'expositions aux actinides, par blessure ou par inhalation. Contact : elias.fattal@u-psud.fr

|
Scooped by
Life Sciences UPSaclay
January 6, 2019 5:03 PM
|

|
Scooped by
Life Sciences UPSaclay
June 12, 2018 4:31 PM
|
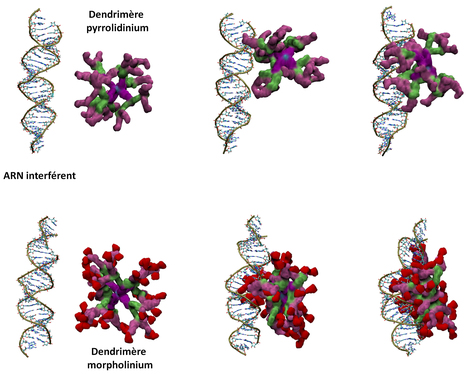
Vu sur le site de l'INC du CNRS. Un des défis de la thérapie génique est de développer de nouveaux vecteurs, ces molécules capables de transporter les « outils thérapeutiques » jusqu’au cœur de la cellule. Les dendrimères, macromolécules à la structure ramifiée, peuvent remplir ce rôle de vecteur. Une équipe franco-suisse montre que la modélisation peut prévoir les différences de comportement constatées entre plusieurs dendrimères similaires, laissant imaginer qu’un grand nombre de tests pourraient être pilotés virtuellement, épargnant ainsi l’effort de nombreuses expériences en laboratoire et sur l’animal. Ces travaux, parus dans Nanoscale, sont le fruit de la collaboration internationale incluant l’Institut Galien Paris-Sud (CNRS/Université Paris-Sud/Université Paris-Saclay, Faculté de Pharmacie, Châtenay-Malabry, membre du LabEx LERMIT), le Laboratoire de chimie de coordination (CNRS), l’Université de Toulouse (UPS/INPT) et le Laboratoire de chimie et de biochimie pharmacologiques et toxicologiques (CNRS/Université Paris Descartes). Très prometteuse, la thérapie génique consiste à envoyer au cœur de la cellule un « messager » qui délivre une information pour remplacer un gène défectueux. Ce « messager » peut également inhiber la production de protéines responsables de pathologies comme dans le cas de certaines inflammations pulmonaires (asthme, broncho-pneumopathie chronique obstructive) qui pourraient être enrayées grâce à un acide nucléique particulier : l’ARN interférent « TNF-Alpha ». La difficulté se trouve dans le transport de cet ARN jusqu’au cœur de la cellule, pour lequel les chercheurs ont eu recours à deux dendrimères. Ces macromolécules arborescentes, chargées positivement en surface, devraient capter l’ARN chargé négativement via des interactions électrostatiques, avant de pénétrer dans la cellule. Mais une première étude menée en 2017 in vitro sur des cellules et in vivo chez la souris témoignait d’une nette différence d’efficacité entre deux dendrimères pourtant très ressemblants. Pour mieux comprendre ces différences de comportement, les chercheurs se sont tournés vers la modélisation moléculaire, en collaboration avec des chercheurs suisses de l’Istituto Dalle Molle di studi sull'Intelligenza Artificiale et de l’Università della Svizzera italiana, pour étudier les interactions entre l’ARN et les deux dendrimères. Ces résultats confirment qu’un des deux dendrimères présente une plus forte affinité avec l’ARN et montrent, de plus, que ce dendrimère se lie avec deux ARN alors que l’autre n’en capte qu’un seul. Cette affinité plus forte explique et confirme la plus grande efficacité d’une des deux thérapies. La modélisation moléculaire montre sa robustesse et son intérêt. En prédisant le degré d’affinité du dendrimère pour l’ARN interférent, elle pourrait permettre un criblage en amont de toute une banque de dendrimères, pour sélectionner les scénarios les plus pertinents, réduisant d’autant le nombre d’expériences à mener in vitro ou in vivo. Contact : nicolas.tsapis@u-psud.fr ou elias.fattal@u-psud.fr

|
Scooped by
Life Sciences UPSaclay
January 13, 2018 5:37 AM
|
Elias Fattal Lauréat du Prix Maurice-Marie Janot 2018
Elias Fattal, Professeur à l’Université Paris-Sud et directeur de l’Institut Galien Paris-Sud (UMR CNRS 8612) a été désigné par un comité scientifique international de 70 personnalités scientifiques « lauréat du Prix Maurice Marie Janot 2018 ». La première édition de ce prix remonte à 1986. Il est décerné par l’association Européenne APGI ( https://www.apgi.org) et sponsorisé par la société Sanofi. Ce prix récompense l'innovation et l'impact scientifique des travaux d’un chercheur en Sciences Pharmaceutiques. Elias Fattal se verra décerner le prix lors du « 11th World Meeting on Pharmaceutics, Biopharmaceutics and Pharmaceutical Technology » qui se tiendra à Grenade (Espagne) du 19 au 22 mars 2018. Ce congrès réunit près de 1500 participants ce qui en fait la première réunion mondiale dans le domaine du drug delivery. A cette occasion, Elias Fattal donnera une conférence plénière intitulée « Tackling physiological resistances to drug delivery ». Dans le palmarès, Elias Fattal succède à une série de scientifiques de renommée mondiale (liste des lauréats https://www.apgi.org/list-of-recipients-of-the-maurice-marie-janot-award/).
Toutes nos félicitations !
|

|
Scooped by
Life Sciences UPSaclay
May 8, 2019 5:10 PM
|
Le Professeur Paul Van Tassel de l'université de Yale aux USA est en séjour pour trois mois à l'Institut Galien Paris-Sud sur un financement Fulbrigth. Il donnera un séminaire le 6 juin à 11 heures à la Faculté de Pharmacie de l'UPSud (Salle AB 19/5, Châtenay-Malabry). Le titre de son séminaire est : "Polyelectrolyte Nanofilms as Biomolecular Delivery Systems".
Paul Van Tassel is Professor of Chemical and Environmental Engineering at Yale University. His research interests include colloidal/interfacial phenomena, polymers, biomaterials, adsorption, molecular computer simulation, and statistical mechanics. He is a National Science Foundation CAREER Awardee, a National Academy of Engineering Frontiers of Engineering Invitee, and a Connecticut Academy of Science and Engineering Elected Member. He has published over 80 peer-reviewed articles, and has been awarded grants from the National Science Foundation, the National Institutes of Health, the American Chemical Society, the Unilever Corporation, the Fulbright Foundation, and the Burroughs-Wellcome Fund. Prof. Van Tassel has held several invited posts in France: Université Pierre et Marie Curie (Paris, 1993-1996), Université Louis Pasteur (Strasbourg, 2006), and Université de Cergy-Pontoise (Paris, 2009 and 2016-17). He holds a BA in Chemistry and Mathematics from Saint Olaf College and a PhD in Chemical Engineering from the University of Minnesota, and lives in New Haven, CT with his wife and three children. Research will be conducted toward the chemical conjugation of a pharmaceutically active molecule to a charged polymer (a polyelectrolyte “prodrug”), and the subsequent complexation of this charged species with an oppositely charged polymer, so as to form a therapeutically active “nanocarrier” particle. By combining the electrostatic macromolecular assembly expertise of Prof. Van Tassel with the nanocarrier and prodrug expertise of the Institut Galien, a new US-France scientific collaboration is envisioned toward novel drug delivery approaches for challenging diseases, such as cancer. Contact : elias.fattal@u-psud.fr

|
Scooped by
Life Sciences UPSaclay
January 22, 2019 12:49 PM
|
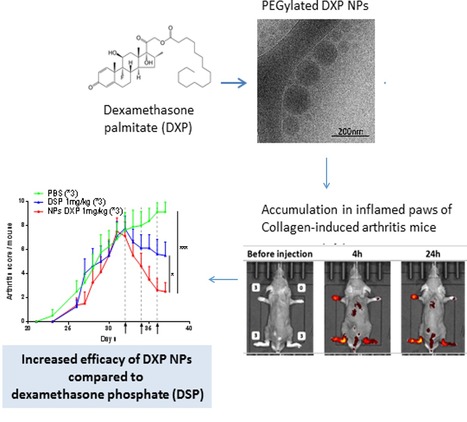
L’utilisation de glucocorticoïdes dans le traitement des maladies inflammatoires, notamment auto-immunes, est entravée par d’importants effets indésirables en raison d’une pharmacocinétique et d’une biodistribution défavorables. Afin de modifier leur devenir dans l’organisme et favoriser leur distribution dans le tissu inflammatoire, les glucocorticoïdes ont été formulés en nanoparticules par les chercheurs de l’Institut Galien Paris-Sud (UMR 8612 CNRS/UPSud à la Faculté de Pharmacie de Châtenay-Malabry, LabEx LERMIT). Pour résoudre le problème de l’encapsulation de ces substances actives hautement cristallines et peu solubles dans l’eau, une prodrogue de dexaméthasone, le palmitate de dexaméthasone, a été stabilisée, sous une forme amorphe, en nanoparticules d’une centaine de nanomètres grâce à son association avec un phospholipide lié au polyéthylène glycol. L’efficacité de cette formulation a été évaluée en collaboration avec l’UMR-S 996 INSERM/UPsud (LabEx LERMIT) sur un modèle de polyarthrite rhumatoïde. L’accumulation passive dans les articulations inflammées a été démontrée par imagerie optique. Elle entraîne la rémission de la maladie et la récupération de la structure articulaire à une dose très faible de dexaméthasone sans aucun effet indésirable. Les nanoparticules de palmitate de dexaméthasone sont prometteuses pour le traitement de l'inflammation dans la polyarthrite rhumatoïde avec une meilleure efficacité par rapport à la forme commerciale de dexaméthasone particulièrement significative lorsque l'inflammation est importante, permettant de prévenir la progression de la maladie. Ces travaux, qui ont fait l’objet de brevet, peuvent être étendus à d’autres glucocorticoïdes. Voire article dans Journal of Controlled Release. Contact : elias.fattal@u-psud.fr et nicolas.tsapis@u-psud.fr

|
Scooped by
Life Sciences UPSaclay
June 23, 2018 5:10 PM
|
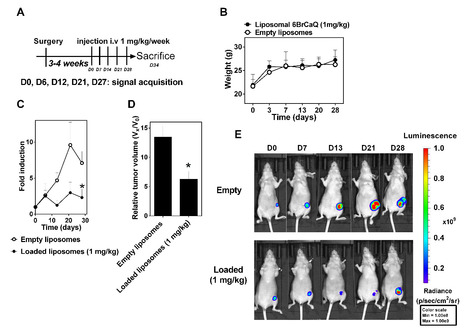
En juin 2018, le fruit d’un travail collaboratif entre l’Institut Galien Paris-Sud (Félix Sauvage, Juliette Vergnaud-Gauduchon, Elias Fattal, Gillian Barratt) et BioCIS (Samir Messaoudi, Mouad Alami), de la Faculté de Pharmacie de l’Université Paris-Sud a été publié dans la revue Cancer Letters. Les auteurs ont identifié le potentiel anti-tumoral de liposomes encapsulant un inhibiteur potentiel de la protéine de choc thermique Hsp90 au niveau de son domaine C-terminal (6BrCaQ, analogue de la novobiocine). Tout d’abord, la réponse cellulaire in vitro à ces liposomes a été caractérisée sur la lignée de cancer du sein MDA-MB-231 : un ralentissement de la prolifération cellulaire a été observé sans induction d’une réponse Heat Shock, observée notamment avec les inhibiteurs N-terminaux de Hsp90 et responsable de la résistance au traitement. Dans un modèle de xénogreffe orthotopique de cancer du sein bioluminescent chez la souris nude (MDA-MB-231-Luc), le 6BrCaQ liposomal, administré une fois par semaine par voie intra-veineuse à 1 mg/kg pendant 4 semaines, induit un ralentissement de la croissance tumorale mesurée par l’activité luciférase et le volume tumoral. Cet effet apparaît plutôt lié à une inhibition de la prolifération des cellules tumorales évaluée par un marquage histologique au Ki67 que par l’induction d’apoptose (marquage de la caspase-3 clivée). Cette étude montre avec succès la possibilité de délivrer in vivo, grâce à des liposomes, un inhibiteur C-terminal de l’Hsp90 très peu soluble dans les milieux biologiques et ainsi de faciliter son développement éventuel en tant que candidat médicament. Contact : juliette.vergnaud@u-psud.fr

|
Scooped by
Life Sciences UPSaclay
February 16, 2018 12:19 PM
|
Les avancées obtenues dans le domaine de la cancérologie ont démontré l’existence d’une population particulière de cellules tumorales, les cellules souches cancéreuses (CSC), jouant un rôle central dans la propagation et la résistance tumorales. Elles sont, d’une part, plus résistantes à la chimiothérapie classique et, d’autre part, douées d’une longue persistance au sein des tumeurs et si elles ne sont pas toutes éliminées, elles vont se différencier et proliférer favorisant les métastases et la rechute tumorale. Les CSC, d'abord identifiées dans le cancer du sein, expriment plusieurs marqueurs parmi lesquels le récepteur CD44. Des chercheurs de l'Institut Galien Paris-Sud (UMR UPSud/CNRS 8612, Faculté de Pharmacie, Châtenay-Malabry) ont construit un nanomédicament capable de cibler ces cellules. L’originalité de leur approche a consisté à associer au sein de ce nanomédicament des acides nucléiques en surface (aptamères) pour la reconnaissance moléculaire du CD44, et des acides nucléiques à l’intérieur (siRNA), destinés à interférer avec l’expression de gènes de ces cellules tumorales. Le nanomédicament est constitué d’un cœur et d’une couronne, le tout mesurant 100 nm. La couronne présente un ligand de type aptamère liant le récepteur CD44 permettant à l’ensemble de reconnaitre spécifiquement et avec une grande affinité les cellules porteuses du récepteur. Les aptamères sont des acides nucléiques (fragments d’ADN ou d’ARN) caractérisés par une forte affinité de fixation et une excellente spécificité vis-à-vis d’une cible donnée. Ils sont en outre parfaitement bien tolérés par l’organisme. Par ailleurs, le cœur du nanomédicament est composé d’une enveloppe lipidique entourant un complexe formé par l’association d’un ARN interférent (siRNA) à de la protamine. Les chercheurs ont observé que l’affinité de l’aptamère pour le récepteur était améliorée par sa présence à la surface des nanomédicaments par rapport à l’aptamère seul. La capture cellulaire des nanovésicules fonctionnalisées a été évaluée sur des lignées cellulaires exprimant CD44 et comparée à une lignée cellulaire ne l’exprimant pas. Les résultats ont montré une internalisation beaucoup plus importante des nanomédicaments par les cellules exprimant le récepteur. Ce système original a été évalué pour l’extinction du gène rapporteur de la luciférase exprimé dans un modèle de cancer du sein triple négatif, in vitro et in vivo en situation orthotopique, avec pour objectif de servir de plateforme pour inhiber à terme toute une série de protéines impliquées dans les processus de maturation et de prolifération des cellules souches cancéreuses, tout en épargnant les cellules saines. Journal of Controlled Release https://doi.org/10.1016/j.jconrel.2017.12.022 Contact : elias.fattal@u-psud.fr, juliette.vergnaud@u-psud.fr, herve.hillaireau@u-psud.fr
|



 Your new post is loading...
Your new post is loading...