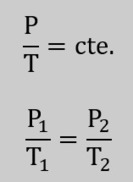Ya vimos en entradas previas dos de las leyes fundamentales de los gases ideales, la ley de Boyle-Mariotte y la ley de Charles. La primera de ellas determina qué sucede con un gas cuando sufre una transformación de un estado 1 a un estado 2 a temperatura constante, mientras que la segunda, la ley de Charles, determina qué pasa con la temperatura y el volumen cuando lo que permanece constante es la presión. Como vemos, tratándose de tres variables fundamentales para los gases ideales, la presión, el volumen y la temperatura, era lógico que también se intentase dar respuesta a la pregunta siguiente: ¿Qué pasa con la presión y la temperatura de un gas ideal cuando mantenemos constante el volumen?
Research and publish the best content.
Get Started for FREE
Sign up with Facebook Sign up with X
I don't have a Facebook or a X account
Already have an account: Login

 Your new post is loading... Your new post is loading...
 Your new post is loading... Your new post is loading...
|