Could the key to lobsters’ longevity slow down our biological clocks?
What lobsters can teach us about immortality
Published on the 20 Sep 2022 by Maddie Massy-Westropp
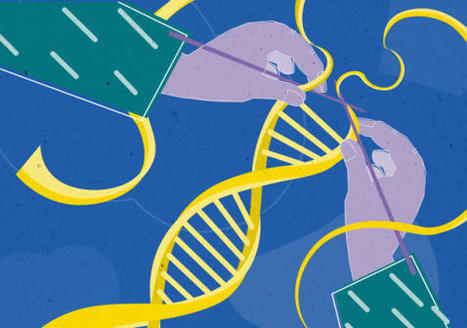
[Image] Longevity is closely linked to cell DNA replication and division. Image: Ian Joson/UNSW. / La longévité est étroitement liée à la réplication et à la division de l'ADN des cellules.
----------
NDÉ
Traduction :
Personne n'aime l'idée de vieillir, mais cela semble être une partie inévitable de la vie. La plupart des espèces croissent, se développent et réparent les dommages subis par leur corps jusqu'à un certain point à l'âge adulte. Après cela, le corps devient moins capable de se réparer et commence lentement à accumuler les dommages.
Mais cela ne semble pas s'appliquer aux homards. Ils continuent de grandir tout au long de leur vie extraordinairement longue - les plus vieux homards connus capturés pesaient plus de neuf kilogrammes, et leur âge est estimé entre 120 et 140 ans.
Les homards ne meurent pas de vieillesse. Ils finissent plutôt au buffet de fruits de mer ou meurent d'épuisement pendant la mue - le processus par lequel ils remplacent leur carapace en raison de leur taille croissante.
Nos cellules ont une "horloge biologique"
Pour comprendre pourquoi les homards vivent si longtemps, nous devons d'abord comprendre le processus de vieillissement.
Les brins d'ADN s'enroulent pour former des chromosomes
Les brins d'ADN s'enroulent en chromosomes, dont les extrémités sont recouvertes de télomères. Image : Ian Joson/UNSW.
Nous sommes constitués de cellules contenant de l'ADN - le code génétique qui ordonne à notre corps d'exécuter toutes les fonctions nécessaires à la vie. Les brins d'ADN linéaires sont regroupés en structures appelées "chromosomes". Chaque chromosome contient des télomères, qui sont des capuchons placés aux extrémités des brins d'ADN pour les protéger des dommages. Les télomères sont comme les embouts en plastique des lacets de chaussures, qui les empêchent de s'effilocher. Sans télomères, l'ADN peut être endommagé et modifier le code génétique, ce qui peut affecter la capacité d'une cellule à fonctionner correctement.
"Vous devez être capable de protéger les informations contenues dans vos gènes, dans votre ADN", a déclaré le Dr Ashwin Unnikrishnan, qui dirige le laboratoire des mécanismes moléculaires de la leucémie à l'UNSW Medicine & Health. "Les cellules ont développé une solution à ce problème en ajoutant ces caractéristiques appelées télomères. Il s'agit essentiellement d'unités répétitives d'ADN qui ne codent pas vraiment d'informations en soi, mais qui peuvent être érodées tout en protégeant les informations au sein du chromosome."
Les télomères sont comme des aiguillettes sur des lacets de chaussures
Les télomères peuvent être comparés aux aiguillettes* sur des lacets de chaussures. Image : Ian Joson/UNSW.
[*embouts en matière plastique ou en métal qui compriment le tissu et évitent son effilochage et qui permettent de glisser plus aisément le lacet dans les œillets de la chaussure, NDÉ]
Chaque cellule de notre corps a une durée de vie limitée et doit se renouveler en se divisant en deux cellules "filles". Avant de se diviser, une cellule doit copier son ADN, ce qui signifie que deux copies de l'ADN sont disponibles - une pour chaque cellule fille. Chaque fois que l'ADN de la cellule est copié, les télomères se raccourcissent.
"Chaque fois que la cellule se divise, il y a un peu d'érosion des télomères. Lorsqu'il atteint une certaine longueur critique, la cellule ne peut plus se diviser", explique le Dr Unnikrishnan.
La longueur des télomères est une "horloge biologique" qui détermine le nombre de divisions que peut effectuer une cellule. Au bout du compte, le télomère restant est trop court et l'ADN est susceptible d'être endommagé. À ce stade, la cellule cesse de se diviser et s'autodétruit ou devient inactive. À mesure que les humains (et la plupart des autres espèces) vieillissent, un grand nombre de nos cellules atteignent ce stade, ce qui signifie que notre corps se décompose et finit par ne plus fonctionner.
Les télomères se raccourcissent pendant la réplication de l'ADN
Les télomères raccourcissent à chaque cycle de division cellulaire.
Image : Ian Joson/UNSW.
Le secret de la longévité du homard
Le homard a une durée de vie extraordinaire grâce à la présence d'une enzyme appelée "télomérase" dans un grand nombre de ses cellules. La télomérase restaure la longueur des télomères, augmentant ainsi le nombre de divisions qu'une cellule peut effectuer avant de mourir ou de devenir inactive. Cela permet aux cellules de continuer à se diviser et aux homards de continuer à se développer et à réparer leur corps - d'où leur très longue vie.
Chez l'homme, la télomérase n'est active que dans certaines cellules spéciales, par exemple les cellules souches, qui peuvent se renouveler pendant de très longues périodes. Les autres cellules de notre corps, qui ne contiennent pas ce que l'on appelle "l'enzyme de l'immortalité", ont une durée de vie limitée jusqu'à l'épuisement des télomères.
Verrons-nous bientôt des thérapies basées sur les télomères ?
Cela nous amène à l'inévitable question : les humains pourraient-ils utiliser la télomérase pour ralentir leur horloge biologique et vivre plus longtemps ? Eh bien, ne faites pas la queue pour votre traitement par télomérase de sitôt - il existe un lien entre l'activité de la télomérase et le cancer.
"La principale raison pour laquelle je suis sceptique à l'égard de cette stratégie est que [la télomérase] n'est pas normalement exprimée dans la plupart des cellules adultes. Mais elle est souvent "activée" dans les cellules cancéreuses... ce qui contribue à maintenir l'"immortalité" du cancer", a déclaré le Dr Lindsay Wu, directeur du Laboratory for Ageing Research à l'UNSW Medicine & Health.
Les cellules cancéreuses, contrairement aux cellules adultes normales, activent souvent l'enzyme télomérase. La télomérase continue de réparer leur ADN et leur permet de se diviser de nombreuses fois sans être contrôlées par une "horloge biologique".
La relation complexe entre les télomères, le vieillissement et le cancer doit être mieux comprise.



 Your new post is loading...
Your new post is loading...